中国科大揭示α-tubulin末端去酪氨酸酶的催化机制及其在有丝分裂中的重要功能
- 时间:2019-06-17 14:05:52 来源:合肥微尺度物质科学国家研究中心
近日, 中国科学技术大学许超教授课题组,南方科技大学黄鸿达教授课题组及丹麦-哥本哈根大学Marin Barisic教授课题组合作,解析了α-tubulin末端去酪氨酸酶复合物SVBP/Vasohibin-1以及该异二聚体分别与α-tubulin羧基端模拟多肽、抑制剂分子epoY的高分辨复合物晶体结构,通过研究其功能突变体的体外/体内酶活确定了SVBP/Vasohibin-1复合体的底物结合界面及催化机制,并通过细胞生物学实验发现其在星体微管的形成中具有重要作用从而参与调节有丝分裂进程。相关成果以“Molecular basis of vasohibins-mediated detyrosination and its impact on spindle function and mitosis”为题,于6月6日以Article形式在线发表于《Cell Research》杂志。
微管是细胞骨架系统的重要组成,微管在维持细胞形态,细胞内物质/细胞器运输,细胞区室化,有丝分裂等重要生命活动中具有不可替代的作用。微管是由α-tubulin/-tubulin异源二聚体在GTP存在下形成的由13条微管原丝环绕形成的中空管状复合物(除鞭毛、纤毛中的特质化微管结构)。微管结构的动态调节对生命活动至关重要,除了通过在微管形成中掺入不同亚型的微管蛋白以及结合各种微管结合蛋白外,微管蛋白的可逆翻译后修饰(如磷酸化、乙酰化、甲基化、谷氨酰化、甘氨酰化、泛素化、SUMO化、酪氨酸/去酪氨酸化)在调节微管动态方面扮演了重要角色。其中微管蛋白的酪氨酸/去酪氨酸在调节微管稳定性方面的研究开展较早,并且负责α-tubulin末端的酪氨酸连接酶在九十年代就已经发现。然而,从发现α-tubulin的去酪氨酸修饰的四十多年来,α-tubulin的去酪氨酸酶一直是未知,直到2017年末,两篇发表于《Science》杂志的文章揭示SVBP/Vasohibin复合物是α-tubulin末端去酪氨酸酶 (PMID: 29146869, 29146868),这才闭环了微管的酪氨酸/去酪氨酸修饰环路。
Vasohibin蛋白家族包含两个同源蛋白VASH1和VASH2,属于非典型的半胱氨酸蛋白酶家族,属于上皮细胞分泌蛋白,其蛋白的稳定性和功能的执行需要其伴侣分子SVBP (Small vasohibin-binding protein)。先前的报道, Vasohibin蛋白在血管生成方面具有重要作用,并且两个同源蛋白VASH1和VASH2的作用是拮抗的,并未发现其执行蛋白酶的功能。通过解析SVBP/Vasohibin-1分别与α-tubulin羧基端模拟多肽的复合物晶体结构,并结合体外生化、质谱、细胞内酶活试验,此研究揭示了VASH1蛋白具有非典型的催化活性中心 (Cys-His-Leu),该催化活性中心在VASH2及其他物种的Vasohibin同源蛋白中保守,同时也揭示SVBP促进VASH1酶活的分子机制。由于微管去酪氨酸化在有丝分裂中的重要性,在细胞内敲低Vasohibin蛋白将抑制有丝分裂期中星体微管的形成。此外,所解析的抑制剂分子epoY与SVBP/Vasohibin-1也揭示了先前epoY不可逆抑制Vasohibin蛋白酶活的分子机制,有助于后续靶向药物的研发。
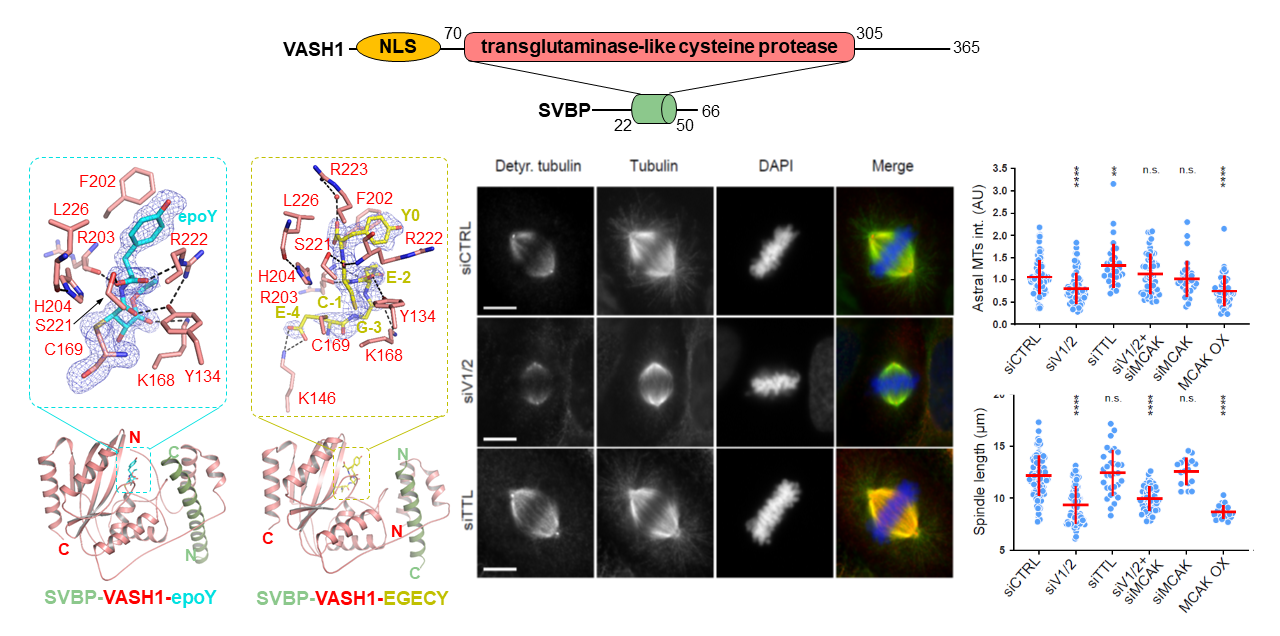
SVBP/VASH1分别与epoY, 模拟α-tubulin羧基端多肽的复合物晶体结构,敲低Vasohibin蛋白会影响纺锤体微管长度,并抑制星体微管的形成。
本文第一作者为许超教授课题组特任副研究员廖善晖、Marin Barisic教授课题组博士后Girish Rajendraprasad、黄鸿达教授课题组博士后汪娜,许超教授、Marin Barisic教授、黄鸿达教授为共同通讯作者。
此工作获得了国家基金委、合肥微尺度物质科学国家研究中心、中组部人才计划及中科院先导项目支持。
论文链接:https://www.nature.com/articles/s41422-019-0187-y
相关文章
- 中国科大揭示了线虫PICS复合物组成机制及其调控piRNA生成和染色体分离的分子机制2021-09-23 12:31:34
- 中国科大揭示了E3泛素连接酶识别羧基端精氨酸-降解决定子的分子机制2021-01-05 23:37:11
- 中国科大发现对piRNA生成以及染色体分离起重要作用的PICS复合物2019-06-24 17:59:09
- 许超课题组与合作者在《eLife》发文揭示SETD3蛋白作为β-actin组氨酸甲基化酶的结构与功能2019-02-26 17:17:34
- 中国科大首次揭示Gemin5的WD40结构域特异识别小核RNA前体分子机理2016-11-14 11:17:34

