中国科大开发毫秒时间分辨冷冻电镜技术,破解神经突触传递生物物理机制
- 时间:2025-10-17 09:00:42 来源:中国科大新闻网
近日,中国科学技术大学(中国科大)合肥微尺度物质科学国家研究中心集成影像中心、生命科学与医学部无膜细胞器与细胞动力学教育部重点实验室、中国科学院深圳先进技术研究院(深圳先进院)脑信息中心毕国强/刘北明/陶长路团队,联合美国加州大学洛杉矶分校周正洪(Z. Hong Zhou)团队、南方科技大学王培毅团队、以及深圳先进院孙坚原团队,通过自主研发的毫秒级时间分辨原位冷冻电镜成像技术,破解了神经信息传递过程中,突触囊泡释放与快速回收的生物物理过程——“亲吻-收缩-逃逸/融合”(Kiss-Shrink-Run/Collapse)(图1)。这一成果统一了半个世纪以来学界关于突触囊泡释放与回收机制的两个争议模型,为理解神经信号传递、神经可塑性及相关脑疾病机理提供全新视角。相关成果于北京时间10月17日发表在《科学》期刊。
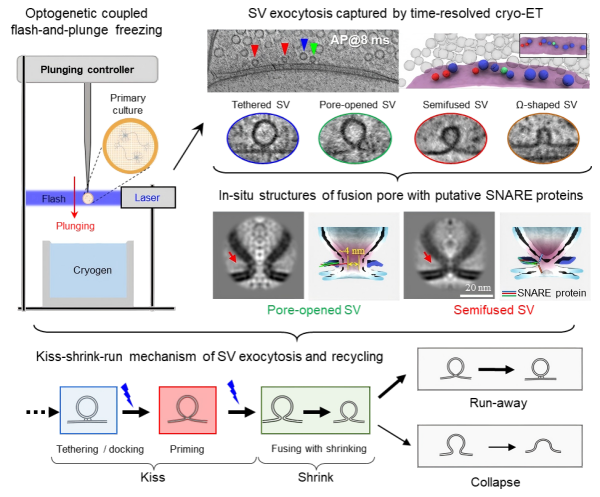
图1. 时间分辨冷冻电镜技术解析突触囊泡释放与回收动态过程
大脑功能的实现,依赖于神经元之间高效而精准的突触传递。当动作电位到达突触前终端时,突触囊泡释放神经递质实现信号的跨神经元传递。20世纪50年代,伯纳德·卡茨(Bernard Katz)提出突触传递过程中神经递质的量子化释放假说,奠定了神经信息传递的细胞机制基础。至1970年代初,学界逐渐形成两种对立的突触囊泡释放模型:全融合(Full-collapse)和亲吻-逃逸(Kiss-and-run)。然而,由于囊泡释放过程发生在毫秒时间尺度、结构变化处于纳米空间尺度,技术手段的局限使得关于这两种模型的争议长期悬而未决,成为困扰神经科学领域半个世纪的难题。
冷冻电镜断层成像技术(cryo-electron tomography, cryo-ET),能够对快速冷冻后近生理状态的细胞样品直接进行三维成像,已成为在细胞原位解析蛋白质等生物大分子结构及其三维空间分布的强有力工具。自2010年起,团队致力于将cryo-ET成像应用于神经突触的结构与功能研究,经过多年攻关,成功实现对原代培养神经细胞中完整突触的cryo-ET成像。进一步,得益于团队自主研发的三维重构软件IsoNet,研究人员清晰分辨出不同形态的突触囊泡;并首次在突触前区域,观测到一类直径约29纳米的“小囊泡”(正常突触囊泡直径在42纳米左右),推测其为囊泡释放的中间状态(图2)。

图2. 冷冻电镜原位成像实现对囊泡三维形态的分割与定量表征
为验证这一猜测,并进一步实现对突触囊泡释放动态过程的精准解析,研究人员将光遗传学刺激与投入式冷冻技术进行耦合,开发出毫秒级时间分辨的冷冻电镜制样技术。具体实验中,在神经元中表达光敏蛋白,利用光刺激精准诱发动作电位,随后在不同时间间隔(4~300毫秒)对细胞进行快速冷冻固定,从而捕捉囊泡释放的瞬时状态。基于此方法,团队获取了上千套高分辨率的神经突触三维重构数据。
随后,研究人员利用cryo-ET子断层三维平均技术(Sub-tomogram average),对不同状态的囊泡进行三维平均。在三维平均图像中,可以清晰分辨出囊泡与细胞膜的半融合结构、囊泡与细胞膜形成的狭小融合孔、以及介导囊泡融合的蛋白复合物,进一步明确了这些囊泡是处于释放的中间状态。另一方面,研究人员通过对上千套突触数据的统计分析,发现了不同形态囊泡的数量随时间的动态变化(图3)。
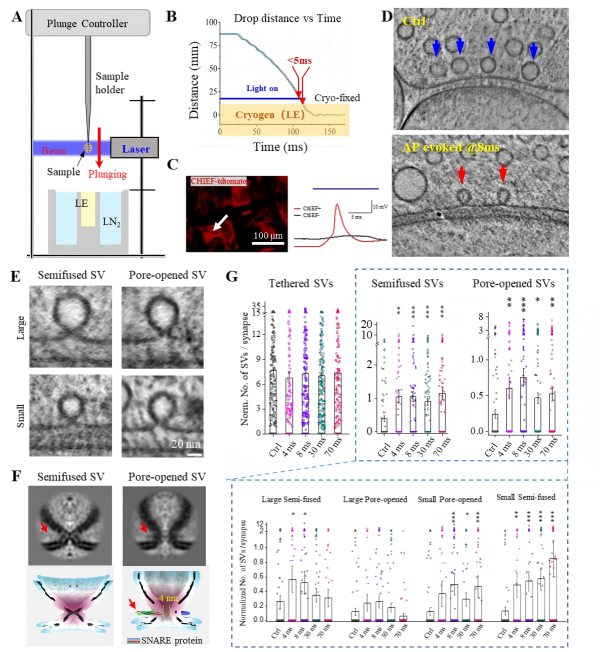
图3. 时间分辨冷冻电镜技术捕捉突触囊泡释放的动态过程
基于上述结果,研究团队绘制出突触囊泡释放与回收的完整过程,并提出全新理论模型:囊泡在动作电位触发后4 毫秒内,先与突触前膜融合形成~4纳米的融合孔(“亲吻”,kiss),随后收缩成表面积为原来一半的小囊泡(“收缩”,shrink),最后,大部分小囊泡在70毫秒内开始以“逃逸”(Run)方式回收,少部分则与突触前膜“全融合”(Collapse)(图4)。
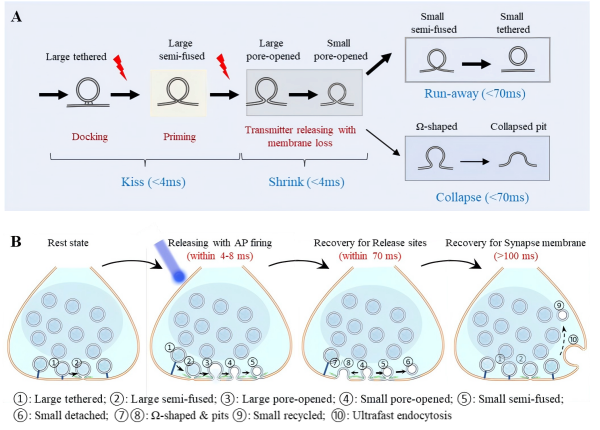
图4.突触囊泡释放与快速回收
这一研究更新了传统认知:囊泡释放并非简单的全融合或亲吻-逃逸,而是包含一个关键的中间收缩阶段。这一“亲吻-收缩-逃逸”机制,不仅统一了争议半个世纪的两种模型,同时提示了神经突触高效与高保真传递的结构基础,也为深入理解神经信号传递、突触可塑性以及相关脑疾病的机理提供了新视角。相关创新技术对研究细胞内其他动态过程也具有应用价值。
中国科大特任副研究员陶长路、博士生田崇礼(现为中国科学院深圳先进院博士后)、博士生刘云涛(现为加州大学洛杉矶分校博士后)、博士生卢振航为该论文的共同第一作者。中国科大与深圳先进院双聘毕国强教授和刘北明教授、中国科大陶长路特任副研究员、美国加州大学洛杉矶分校周正洪(Z. Hong Zhou)教授为本论文的共同通讯作者。南方科技大学王培毅(现山东农业大学教授)团队、深圳先进院孙坚原团队为本研究提供了重要支持。中国科大合肥微尺度物质科学国家研究中心集成影像中心、南方科技大学冷冻电镜中心、加州大学洛杉矶分校电子纳米成像中心为本项目实验开展提供了关键平台支撑。本研究获科技创新2030-“脑科学与类脑研究”重大项目、国家自然科学基金、中国科学院战略性先导科技专项、广东省和深圳市等科技项目资助。
相关文章
- 中国科大突破性实现小鼠全身"高清全景成像", 绘制周围神经亚细胞级图谱2025-07-10 23:08:39
- 中国科大合作开发最轻的头戴式荧光显微镜(0.43g)2024-02-04 14:26:32
- 冷冻电镜原位成像技术算法取得重要突破2022-11-04 23:00:26
- 中国科大/中科院深圳先进院解析猕猴大脑微米分辨率三维结构2021-07-26 23:36:45
- 中国科大/中科院深圳先进院毕国强团队破解抑制性神经突触中受体蛋白的组织规则2020-11-03 21:40:06
- 中国科大成功解析人类疱疹病毒6B型近原子分辨率冷冻电镜结构2019-11-29 23:32:25

