中国科大发展固体核磁共振方法揭示氟离子通道渗透机制
- 时间:2023-08-31 23:42:59 来源:中国科大新闻网
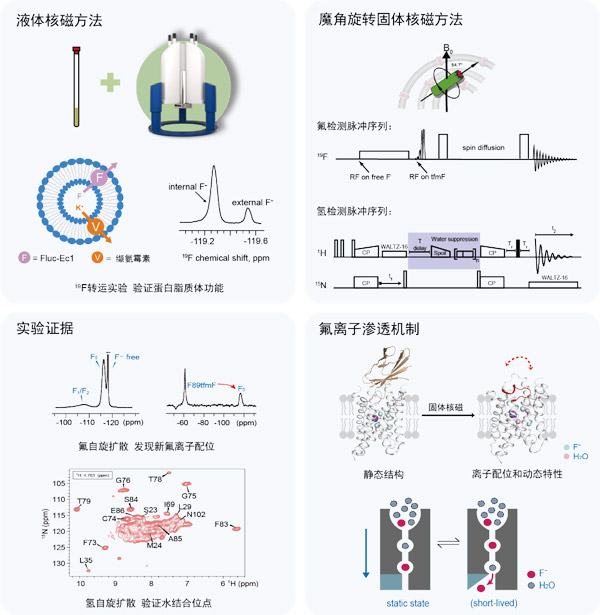
核磁共振方法除可获得分子结构信息外,还可观测分子的动态特性,这些可为阐明蛋白质等生物大分子的功能机制提供重要信息。随着高速魔角旋转技术的发展,固体核磁谱分辨率大幅提高,从理论上突破了液体核磁观测的分子量的限制,逐渐被运用于研究磷脂膜环境中的膜蛋白等超大生物分子复合物体系的动态构象。但低信号强度和低分辨率限制了生物分子固体核磁研究的广泛开展。自然界中氢原子和氟原子的旋磁比大、NMR信号强,是比较理想的NMR观测对象。氟原子在生物分子结构中极少存在,无观测背景信号,是理想的NMR观测探针。因此,氢检测和氟检测方法的发展可能显著扩展固体核磁在复杂生物体系中的运用。
2023年8月23日,中国科学技术大学微尺度物质科学国家研究中心史朝为课题组在国际著名学术期刊ScienceAdvances上在线发表了题为“Fluoride permeation mechanism of the Fluc channel in liposomes revealed by solid-state NMR”的研究论文,研究团队以氟离子通道蛋白Fluc-Ec1作为研究对象,结合氘代和19F定点标记方法,发展并优化膜蛋白固体核磁氢检测及氟检测研究方案,为膜蛋白核磁研究提供新思路。

环境中的氟离子可通过弱酸积累效应在细菌细胞内积累,产生毒害作用。微生物通过F-膜转运蛋白将F-运输至体外进而抑制其毒性作用。来自Fluc(fluoridechannel)家族的Fluc-Ec1蛋白是由130个左右的氨基酸组成的离子通道,具有独特的双重拓扑二聚体的结构,且对氟离子具有高度选择性。静态的F-通道蛋白的晶体结构难以描述F-渗透的具体机制,F-通道蛋白被抗体类似物固定在一种构象上。氟原子和氧原子相似的电子云密度以及分子动力学模拟数据使得晶体结构中极性轨道(polartrack)上的氟离子结合位点(F1and F2sites)引发争议,另外突变体功能保留或丧失的机制目前仍不清楚。
研究团队通过观测磷脂膜环境中的Fluc-Ec1在不同氟离子浓度中的构象,结合基因密码子扩展方法,在蛋白质前庭位置引入非天然氨基酸三氟甲基苯丙氨酸(tfmF),设计19F-19F自旋扩散实验,验证了Fluc-Ec1存在新的氟离子结合位点(F0site)。研究团队利用1H-1H自旋扩散实验直接检测水和蛋白质的相互作用,通过氘代来减少氢原子的非相干背景,结合water-hNH谱图以及自旋扩散传递和衰减规律,得到了主链酰胺质子和水分子的距离信息,证明了F1位点结合的是水,而不是氟。
此外,晶体学研究无法从结构的角度解释F80M突变体具有功能活性而F83M突变体丧失功能活性的现象,研究团队通过分别对比F80M、F83M和野生型蛋白脂质体样品的碳检测谱图,结合液体核磁共振技术验证loop 1突变体功能,发现loop 1是F83M突变体丧失通道活性的重要因素,进一步揭示了loop 1在F-渗透过程中的重要性。综上,研究团队更正了先前推测的氟离子通道离子配位位点,提出氟-水交替“water-mediated knock-on”的渗透模型,为全面理解Fluc通道中的渗透和门控机制提供科学依据。
中国科学技术大学张瑾、宋丹、李娟以及德国亚琛工业大学的Florian Karl Schackert为该论文的共同第一作者,中国科学技术大学微尺度物质科学国家研究中心史朝为特任研究员为该文章的通讯作者。中国科学技术大学的龚为民教授、田长麟教授、项晟祺教授以及德国Jülich研究中心的Paolo Carloni和Mercedes Alfonso-Prieto教授团队也参与了该研究工作并给予了大力帮助。该研究得到了科技部、国家自然科学基金、中国科学院、中国科学技术大学以及德国科学基金会的经费资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.adg9709
相关文章
- 史朝为2020-04-16 14:47:14

