中国科大解析人类胆汁盐外排蛋白ABCB11的电镜结构
- 时间:2020-03-27 14:30:57 来源:中国科大新闻网
中国科学技术大学微尺度物质科学国家研究中心和生命科学与医学部陈宇星教授、周丛照教授、孙林峰教授课题组合作,利用冷冻电镜技术解析了人类胆汁盐外排蛋白ABCB11的近原子分辨率三维结构,为深入理解该类膜蛋白的转运机制以及其突变引发的致病机理提供了基础。该研究成果以“Cryo-EM structure of human bile salt exporter ABCB11”为题于2020年3月20日在线发表在《Cell Research》上。
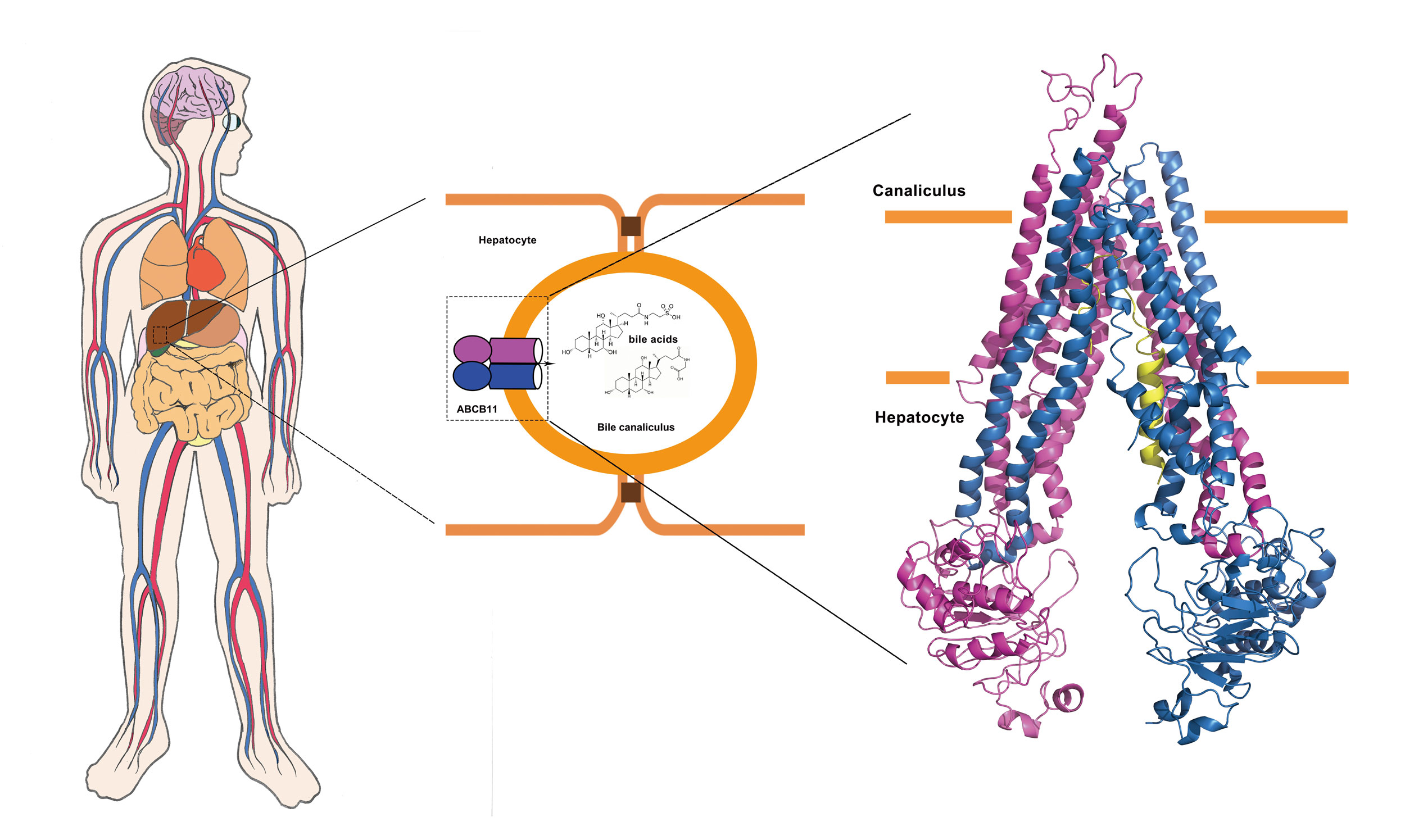
胆汁盐为人体胆汁的重要组成部分,由胆固醇作为前体在肝细胞中合成,经膜蛋白将其转运至胆小管中参与胆汁的形成。胆汁主要在小肠中帮助脂肪类物质的消化和吸收,胆汁盐的外排阻塞会导致一系列的胆汁淤积相关病症。比如,进行性家族性肝内胆汁淤积(PFIC),良性复发性肝内胆汁淤积(BRIC),妊娠期肝内胆汁淤积(ICP),药物诱导的肝损伤(DILI)。其中PFIC最为严重,该病多发于儿童,伴随肝肿大,肝硬化,以至肝功能衰竭最后导致成年前死亡,大部分该病患者需要进行肝移植得以存活。
研究表明,胆小管上的ABC膜转运蛋白ABCB11是胆汁盐外排到胆小管中最重要的蛋白。该蛋白编码基因突变会导致上述提到的各种胆汁淤积病症。自发现该基因的近20多年来,对ABCB11的研究报道持续不断,但人们对该蛋白转运胆汁盐的机理仍然不清楚。作者借助冷冻电镜技术解析了该蛋白开放状态下的3.5Å 高分辨率的三维结构。该蛋白由1321个氨基酸残基组成,以单体的形式发挥功能。结构上包含两个彼此靠近的跨膜结构域(TMD)和两个分开的胞内核算结合结构域(NDB)以及一个N端的α螺旋,整体呈现对肝细胞内开放的构象。
根据该结构提供的三维空间信息,作者对临床上该蛋白的突变体致病机理进行了分析。作者发现,临床样本的突变会破坏蛋白质分子内部的相互作用,或者使蛋白错误折叠,导致蛋白质转运功能降低或者完全丧失,最终引发相关疾病。作者还对一系列胆汁盐以及两种抑制剂(利福平、格列本脲)的刺激ATP水解活性的进行了验证,发现利福平和格列本脲以竞争方式抑制该蛋白的活性,这也是服用这类药物导致肝损伤的主要原因之一。该项研究不仅对于该类蛋白的分子结构研究具有重要的参考意义,也为相关疾病的致病机理分析以及药物开发设计提供了理论指导。
中国科学技术大学陈宇星教授、周丛照教授和孙林峰教授为该论文的共同通讯作者。中国科学技术大学在读博士生王亮和特任副研究员侯文韬为该论文的共同第一作者。冷冻电镜数据收集工作在上海科技大学生物成像中心完成。该研究得到了科技部、国家自然科学基金委和中科大新医学项目的资助。
文章链接:https://www.nature.com/articles/s41422-020-0302-0
相关文章
- 中国科大在植物激素油菜素内酯运输领域取得重要进展2024-03-22 09:28:41
- 中国科大在植物生长素转运机制研究中取得重要进展2022-08-02 23:36:08
- 中国科大揭示光合固碳关键酶RuBisCO组装的精细调控机理2020-05-27 16:39:55
- 中国科大解析致病菌细胞壁成分胞壁酸翻转酶的结构和功能机制2020-03-24 16:03:08
- 中国科大首次解析人类溶酶体维生素B12外排蛋白ABCD4的电镜结构2019-09-02 17:25:18
- 中国科大关于巢湖水华蓝藻天敌的研究取得进展2019-08-12 18:21:56

